Ácido sulfuroso
| Ácido sulfuroso | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Dihidrogeno(trioxidosulfato), Dihidroxidooxidoazufre | ||
| General | ||
| Otros nombres |
Trioxosulfato (IV) de hidrógeno Sulfito de hidrógeno | |
| Fórmula semidesarrollada | H2SO3 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7782-99-2[1] | |
| ChEBI | 48854 | |
| ChEMBL | CHEMBL1161699 | |
| ChemSpider | 1069 | |
| PubChem | 1100 | |
| UNII | J1P7893F4J | |
| KEGG | C00094 | |
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 1030 kg/m³; 1,03 g/cm³ | |
| Masa molar | 8207 g/mol | |
| Compuestos relacionados | ||
| Compuestos relacionados |
Óxido de azufre (II) Óxido de azufre (IV) Óxido de azufre (VI) Ácido sulfúrico Ácido peroxosulfúrico Ácido peroxodisulfúrico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido sulfuroso[2] o ácido trioxosulfúrico (IV) [3] es un ácido mineral que se forma al disolverse el óxido de azufre (IV) en agua. Es un líquido incoloro, inestable y de fuerte olor a azufre; se emplea en la síntesis de productos químicos y medicinales, elaboración del papel, reactivo analítico y para el refinado de productos derivados del petróleo. Es un agente reductor potente y se puede usar por ejemplo para blanquear manchas en materiales dañados por cloro. Se puede formar cuando el óxido de azufre (IV) se disuelve en las gotas de lluvia, causando lluvia ácida.
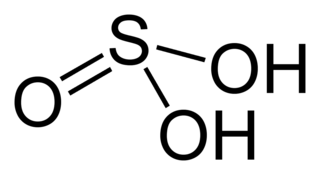
Fórmula química del ácido sulfuroso
[editar]Se conoce por la fórmula H2SO3 que se conforma cor 2 átomos de hidrógeno, 1 de azufre y 3 de oxígeno.
Sales y ésteres
[editar]Sus sales y ésteres son conocidos como sulfitos.
En el laboratorio se prepara añadiendo ácido clorhídrico a una disolución de sulfito de sodio en agua.
Su fórmula es::
Obtención
[editar]Existen dos formas de obtener ácido sulfuroso.
Naturalmente
[editar]Se obtiene de forma natural cuando se mezcla el óxido de azufre con la lluvia. El óxido de azufre se genera por los procesos industriales para la tostación de los sulfuros minerales o la quema de combustibles fósiles que contienen azufre.
También se puede encontrar en algunos elementos de la naturaleza como en aguas minerales, plantas y volcanes
De forma mecánica
[editar]Se puede obtener de varias formas, una de ellas es cuando se encuentra disponible en su forma ácida se prepara con sus sales de sodio o de potasio. Otra forma es mediante la mezcla con la solución de ácido muriático y sulfito de sodio en agua, este método es empleado principalmente en los laboratorios
Función
[editar]Este ácido a pesar de ser inestable y débil es bastante corrosivo y contiene características como agente reductor, ya que mediante una reacción química llamada reducción-oxidación el ácido cede parte de sus electrones de uno de los agentes hacia el otro. También es empleado como decolorante de materiales de composición vegetal como por ejemplo las telas de lana y algodón.
Propiedades
[editar]- Punto de ebullición: 337 °C.
- Solubilidad: En agua, alcohol y dióxido de azufre
- Masa molecular: 82.073 g/mol.
- Descripción física: Líquido incoloro
- Densidad: 1030 kg/m3 o 1,03 g/cm3
- Presión a vapor: es de 1740 kPa a unos 21 °C
- Acidez: 1.81-1.857 pKa.[4]
- pH: 1,5 en la escala de pH
- Descomposición: Al calentarse el ácido sulfuroso se descompone emitiendo un humo tóxico de oxido de azufre
- Olor: picante
- Solidificación: −76 °C.
Usos frecuentes
[editar]Los usos y aplicaciones que tiene el ácido sulfuroso son amplias entre ellas se puede destacar
En la industria
[editar]Es empleado para la fabricación de productos químicos para crear compuestos que se utilizan para la creación de productos de consumo como el blanqueador que es utilizado en la elaboración del papel y para quitar manchas de cloro en diversos materiales, y como ingrediente pesticida para la elaboración de raticidas. Se utiliza en la industria petrolera para la refinación del petróleo y sus derivados. También son utilizadas varias sales del ácido sulfuroso para extracción de la pulpa de la madera.
En la medicina
[editar]El ácido sulfuroso en el área médica se emplea como antiséptico, siendo eficaz para evitar las infecciones de la piel, para combatir la sarna y para la descomposición en partes del organismo al eliminar los microbios del tejido vivo. Generalmente es un componente base para la elaboración de algunos medicamentos y cremas para el cuidado de la piel, también se emplea como blanqueador dental.
En la comida
[editar]Este ácido es comúnmente usado para preservar las frutas y verduras, como aditivo, como elemento antioxidante, antibacteriano y fungicida , para evitar la fermentación de bebidas como en la cerveza y en los vinos y que mejora la intensidad del color y sabor en estos productos.
En la vida cotidiana
[editar]Por su facilidad para crear compuestos químicos es utilizado para producción de cosméticos, desinfectantes, entre otros.
Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ «Ácido Sulfuroso Fórmula Química, Usos, Propiedades, Ejemplos». acidos.co. Que es el ácido sulfuroso. Consultado el 19 de noviembre de 2022.
- ↑ «H2SO3 / ácido trioxosulfúrico (IV)». www.formulacionquimica.com. Consultado el 27 de noviembre de 2019.
- ↑ «H2SO3 / ácido trioxosulfúrico (IV)». Formulación Química. Propiedades. Consultado el 19 de noviembre de 2022.

